0.0.0.1 ↑ Carbonylverbindungen
Funktionelle Gruppe:
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & ^{/} & \text{O} & ^{\backslash} & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & ^{/} & & ^{\backslash} & \\ {} \text{R}_1 & & & & \text{R}_2 \end{array}
Alkanale (Aldehyde)
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & ^{/} & \text{O} & ^{\backslash} & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & ^{/} & & ^{\backslash} & \\ {} \text{H} & & & & \text{R}_2 \end{array}
- a)
Beispiele
Name Strukturformel Siedepunkt (°C) Wasserlöslichkeit Bedeutung und Verwendung Methanal (Formaldehyd) \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} \text{H} & & & & & \\ {} & \backslash{} & & & & \backslash{} \\ {} & & \text{C} & = & \text{O} & \\ {} & / & & & & / \\ {} \text{H} & & & & & \end{array} -19 + Konservation organischer Stoffe, Desinfektionsmittel Ethanal (Acetaldehyd) \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \text{H} & & \text{H} \\ {} & & & / & & / & \\ {} \text{H} & - & \text{C} & - & \text{C} & & \\ {} & & & \backslash{} & & \backslash\!\backslash{} & \\ {} & & & & \text{H} & & \underline{\text{O}}| \end{array} 21 + Zwischenprodukt beim Alkoholabbau Propanal (Propionaldehyd) \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & & & & & & & \overline{\text{O}}| \\ {} & | & & | & & & /\!/ & \\ {} - & \text{C} & - & \text{C} & - & \text{C} & & \\ {} & | & & | & & & \backslash{} & \\ {} & & & & & & & \text{H} \end{array} 48 - Kunst- und Duftstoffe, Arzneimittel (XXX) Hexanal (Capronaldehyd) \text{C}_5\text{H}_{11}{-}{ \setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} & & \text{H} \\ {} & / & \\ {} \text{C} & & \\ {} & \backslash\!\backslash{} & \\ {} & & \underline{\text{O}}| \end{array} } 130 - Anstrichmittel (XXX) Benzaldehyd [Benzolgruppe mit \setlength{\arraycolsep}{0pt} \begin{array}{cccc} {} & & & \overline{\text{O}}| \\ {} & & /\!/ & \\ {} - & \text{C} & & \\ {} & & \backslash{} & \\ {} & & & \text{H} \end{array} dran] 180 - Duft- und Aromastoffe - b)
Chemische Eigenschaften
Oxidierbar zu Carbonsäure
{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} \text{R}_1 & & & & & \\ {} & \backslash{} & & & & \backslash{} \\ {} & & \text{C} & = & \text{O} & \\ {} & / & & & & / \\ {} \text{H} & & & & & \end{array} } + 2\,\text{OH}^- \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} \text{R}_1 & - & \text{C} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array} } + \text{H}_2\text{O} + 2\,e^-
→ Nachweis: Silberspiegel- oder Fehlingprobe
Ketone (Alkanone)
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & ^{/} & \text{O} & ^{\backslash} & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & ^{/} & & ^{\backslash} & \\ {} \text{R}_1 & & & & \text{R}_2 \end{array}
\text{R}_1, \text{R}_2 \neq \text{H}
- a)
Beispiele
- Propanon (Aceton)
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & ^{/} & \text{O} & ^{\backslash} & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & ^{/} & & ^{\backslash} & \\ {} \text{H}_3\text{C} & & & & \text{C}\text{H}_3 \end{array}
Siedepunkt: 56 °C
[Verwendung:] Lösungsmittel, Tränengas
- Butanon
\setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & ^{/} & \text{O} & ^{\backslash} & \\ {} & & \vert\vert{} & & \\ {} & & \text{C} & & \\ {} & ^{/} & & ^{\backslash} & \\ {} \text{H}_3\text{C} & & & & \text{C}_2\text{H}_5 \end{array}
- b)
Chemische Eigenschaften
nicht weiter oxidierbar → Unterscheidung von den Alkanalen
Nucleophile Addition an die Carbonylgruppe
- Versuch
Trichlorethanal + Wasser
- Beobachtung
Feststoff entsteht.
- Erklärung
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & |\overline{\text{Cl}}| & & & & \overline{\text{O}}| \\ {} & & | & & & /\!/ & \\ {} |\overline{\underline{\text{Cl}}} & - & \text{C} & - & \text{C} & & \\ {} & & | & & & \backslash{} & \\ {} & & |\underline{\text{Cl}}| & & & & \text{H} \end{array} } + { \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{H} & - & \overline{\underline{\text{O}}} & - & \text{H} \end{array} } \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & & |\overline{\text{Cl}}| & & & & \overline{\underline{\text{O}}} & - & \text{H} \\ {} & & | & & & / & & & \\ {} |\overline{\underline{\text{Cl}}} & - & \text{C} & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{H} \\ {} & & | & & & \backslash{} & & & \\ {} & & |\underline{\text{Cl}}| & & & & \text{H} & & \end{array} } \text{ (Chloralhydrat)}
Die Addition[sbereitschaft] von Wassermolekülen an die Carbonylgruppe ist eine chemische Eigenschaft der Alkanale und Alkanone. Es bilden sich Hydrate.
→ Typische gemeinsame Reaktion der Alkanale und Alkanone
Starke Polarität der Carbonylgruppe aufgrund der hohen Elektronegativität des Sauerstoffatoms
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} ^{\delta^+}\text{C} & = & {\text{O}_/^\backslash}^{\delta^-} \end{array} } \leftrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccc} {} ^\oplus\text{C} & - & \overline{\underline{\text{O}}}|^\ominus \end{array} }
Allgemein:
{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} \text{R}_1 & & & & & \\ {} & \backslash{} & & & & \backslash{} \\ {} & & \text{C} & = & \text{O} & \\ {} & / & & & & / \\ {} \text{R}_2 & & & & & \end{array} } + { \setlength{\arraycolsep}{0pt} \begin{array}{cccc} {} | & \text{Nu} & - & \text{H} \end{array} } \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} \text{R}_1 & & & & \overline{\underline{\text{O}}} & - & \text{H} \\ {} & \backslash{} & & / & & & \\ {} & & \text{C} & & & & \\ {} & / & & \backslash{} & & & \\ {} \text{R}_2 & & & & \text{Nu} & & \end{array} }
Nucleophile: Wasser, Ammoniak, Hydrogenchlorid, Blausäure (HCN), alle Alkanole (\text{R}{-}\overline{\underline{\text{O}}}{-}\text{H})
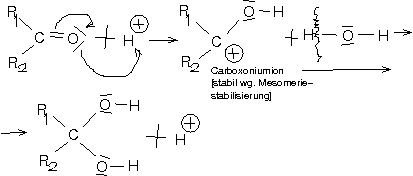
Säurekatalysierter Mechanismus
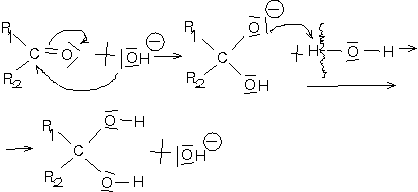
Basenkatalysierter Mechanismus
Beispiele:
Nucleophile Addition von \text{NH}_3 an Propanal:
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & & & \overline{\text{O}}| \\ {} & & & & & /\!/ & \\ {} \text{H}_3\text{C} & - & \text{CH}_2 & - & \text{C} & & \\ {} & & & & & \backslash{} & \\ {} & & & & & & \text{H} \end{array} } + |\text{NH}_3 \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & & & & & & \overline{\underline{\text{O}}} & - & \text{H} \\ {} & & & & & / & & & \\ {} \text{H}_3\text{C} & - & \text{CH}_2 & - & \text{C} & - & \underline{\text{N}} & \text{H}_2 & \\ {} & & & & & \backslash{} & & & \\ {} & & & & & & \text{H} & & \end{array} }
Nucleophile Addition von HCN an Propanal:
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & & & \overline{\text{O}}| \\ {} & & & & & /\!/ & \\ {} \text{H}_3\text{C} & - & \text{CH}_2 & - & \text{C} & & \\ {} & & & & & \backslash{} & \\ {} & & & & & & \text{H} \end{array} } + ^\ominus|\text{C}{\equiv}\text{N}| \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & & & & & & \overline{\underline{\text{O}}}| & ^\ominus & \\ {} & & & & & / & & & \\ {} \text{H}_3\text{C} & - & \text{CH}_2 & - & \text{C} & - & \text{C} & {\equiv} & \text{N}| \\ {} & & & & & \backslash{} & & & \\ {} & & & & & & \text{H} & & \end{array} }
[zuvor: \text{H}{-}\text{C}{\equiv}\text{N} \longrightarrow \text{H}^+ + ^\ominus|\text{C}{\equiv}\text{N}|, da Blausäure ja eine Säure ist]
Addition von Alkanalen
Halbacetalbildung
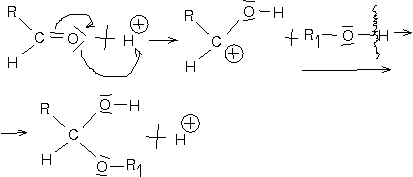
Vollacetalbildung

Weitere Nachweise der Aldehydgruppe
\text{Aldehyd} + \text{KMnO}_4 \longrightarrow
[Aldehyde werden oxidiert, andere Moleküle – z.B. \text{KMnO}_4 – reduziert.]
Aldehyd + SCHIFFsches Reagenz \longrightarrow Farbvertiefung
[Addition von Blausäure zur Kettenverlängerung]
[Wenn ein C oder ein N eines \text{C}{\equiv}\text{N} potentiell angreifen könnte, greift bei uns immer das C an.]
[Wichtig: Mesomeriestabiliserung der positiven Ladung des C-Atoms (Überklappen eines Elektronenpaars des \overline{\underline{\text{O}}} zum C → damit trägt das \underline{\text{O}} die positive Ladung.]