0.0.0.1 ↑ Carbonsäuren
0.0.0.1.1 ↑ Funktionelle Gruppe: Carboxygruppe
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccrl} {} & & & & \overline{\text{O}}| & & & \,\,\,\} & \\ {} & & & /\!/ & & & & \,\,\,\} & \,\text{Carbonylgruppe} \\ {} \text{R} & - & \text{C} & & & & & \,\,\,\} & \\ {} & & & \backslash{} & & & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} & \,\,\,\} & \,\text{Hydroxygruppe} \end{array}
0.0.0.1.2 ↑ Einteilung der Carbonsäuren
Eine COOH-Gruppe → Monocarbonsäure
Zwei COOH-Gruppen → Dicarbonsäure
[Beispiel:] Oxalsäure
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccc} {} & & |\overline{\text{O}} & & & & ^/\text{O}^\backslash & & & & & & \overline{\text{O}}| & & \\ {} & & & \backslash\!\backslash & & & \vert\vert{} & & | & & & /\!/ & & & \\ {} & & & & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & & & & \\ {} & & & / & & & & & | & & & \backslash{} & & & \\ {} \text{H} & - & \overline{\underline{\text{O}}} & & & & & & & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array}
∣ O ¯ ∕ O ∖ O ¯ ∣ ∖ ∖ ∣ ∣ ∣ ∕ ∕ C − C − C − C ∕ ∣ ∖ H − O ¯ ¯ O ¯ ¯ − H [Mehr als zwei COOH-Gruppen pro C-Atom gibt's nicht (XXX).]
R [ist] aliphatisch [kettenförmig, IIRC] → Alkan-, Alken-, Alkinsäure
R [ist] aromatisch → aromatische Carbonsäure
[Andere Möglichkeiten auch zulässig, aber keine spezielle Benennung (zumindest für uns)]
0.0.0.1.3 ↑ Vertreter
Methansäure (Ameisensäure):
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} \text{H} & - & \text{C} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array}
O ¯ ∣ ∕ ∕ H − C ∖ O ¯ ¯ − H - a)
Vorkommen
Ameisen, Brennnessel
- b)
Eigenschaften
Farblose Flüssigkeit
Stechender Geruch
Sauer
Versuch: Ameisensäure + \text{KMnO}_4
KMnO 4 Beobachtung: Braunfärbung und Gasentwicklung
Erklärung:
\text{H}{\stackrel{+2}{\text{C}}}\text{OOH} + 2\,\text{H}_2\text{O} \longrightarrow {\stackrel{+4}{\text{C}}}\text{O}_2 + 2\,e^- + 2\,\text{H}_3\text{O}^+
H C + 2 OOH + 2 H 2 O → C + 4 O 2 + 2 e − + 2 H 3 O + {\stackrel{+7}{\text{Mn}}}\text{O}_4^- + 5\,e^- + 8\,\text{H}_3\text{O}^+ \longrightarrow {\stackrel{+2}{\text{Mn}}}^{2+} + 12\,\text{H}_2\text{O}
Mn + 7 O 4 − + 5 e − + 8 H 3 O + → Mn + 2 2 + + 1 2 H 2 O 5\,\text{H}{\stackrel{+2}{\text{C}}}\text{OOH} + 2\,{\stackrel{+7}{\text{Mn}}}\text{O}_4^- + 6\,\text{H}_3\text{O}^+ \longrightarrow 5\,\text{CO}_2 + 2\,{\stackrel{+2}{\text{Mn}}}^{2+} + 14\,\text{H}_2\text{O}
5 H C + 2 OOH + 2 Mn + 7 O 4 − + 6 H 3 O + → 5 CO 2 + 2 Mn + 2 2 + + 1 4 H 2 O Die Ameisensäure nimmt aufgrund ihrer reduzierenden Wirkung eine Sonderstellung bei den Carbonsäuren ein.
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{\textbf{O}}}| & & \\ {} & & & /\!/ & & & \\ {} \text{\textbf{H}} & - & \text{\textbf{C}} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array}
O ¯ ∣ ∕ ∕ H − C ∖ O ¯ ¯ − H [Carbonylgruppe mit H statt C-Rest = Aldehyd (oxidierbar) statt Keton (nicht oxidierbar)]
Löslich in Wasser
Siedepunkt 100,7 °C
- c)
Darstellung
[Einschub:] Versuch: Zerlegung der Armeisensäure: \text{HCOOH} \longrightarrow \text{CO} + \text{H}_2\text{O}
HCOOH → CO + H 2 O \text{NaOH} + \text{CO} \longrightarrow \text{HCOONa (Natriumformiat)}
NaOH + CO → HCOONa (Natriumformiat) \text{HCOONa} + \text{H}_2\text{SO}_4 \longrightarrow \text{HCOOH} + \text{Na}_2\text{SO}_4
HCOONa + H 2 SO 4 → HCOOH + Na 2 SO 4
- d)
[Verwendung
Reinigungsmittel
Zigarettenrauch
Schädlingsbekämpfungsmittel]
Ethansäure (Essigsäure):
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & & & & & \overline{\text{O}}| & & \\ {} & | & & & /\!/ & & & \\ {} - & \text{C} & - & \text{C} & & & & \\ {} & | & & & \backslash{} & & & \\ {} & & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array}
O ¯ ∣ ∣ ∕ ∕ − C − C ∣ ∖ O ¯ ¯ − H \text{CH}_3\text{COOH}
CH 3 COOH Propansäure (Propionsäure): \text{C}_2\text{H}_5\text{COOH}
C 2 H 5 COOH Butansäure (Buttersäure): \text{C}_3\text{H}_7\text{COOH}
C 3 H 7 COOH Hexadecansäure (Palmitinsäure): \text{C}_{15}\text{H}_{31}\text{COOH}
C 1 5 H 3 1 COOH Benzolcarbonsäure (Benzoesäure):
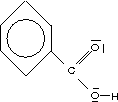
Octadecansäure (Stearinsäure): \text{C}_{17}\text{H}_{\text{35}}\text{COOH}
C 1 7 H 35 COOH
0.0.0.1.4 ↑ Eigenschaften der Carbonsäuren
- a)
Physikalische Eigenschaften
Siedepunkt: Höher als bei Alkanen und Alkanalen durch Wasserstoffbrückenbindungen.
→ Dimerisation
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & & & & \overline{\text{O}}| & \cdot & \cdot & \ \cdot\ \cdot\ \cdot & \text{H} & - & \overline{\underline{\text{O}}} & & & & & & \\ {} & & & /\!/ & & & & & & & & & & \backslash{} & & & \\ {} \text{R} & - & \text{C} & & & & & & & & & & & & \text{C} & - & \text{R} \\ {} & & & \backslash{} & & & & & & & & & & /\!/ & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} & \cdot\ \cdot\ \cdot\ & \cdot & \cdot & |\underline{\text{O}} & & & & & & \end{array}
O ¯ ∣ ⋅ ⋅ ⋅ ⋅ ⋅ H − O ¯ ¯ ∕ ∕ ∖ R − C C − R ∖ ∕ ∕ O ¯ ¯ − H ⋅ ⋅ ⋅ ⋅ ⋅ ∣ O ¯ [Zwei Brücken → "Molekül bestehend aus zwei Submolekülen"; sehr starker Zusammenhalt]
[Bei Alkanalen könnte es mit der Argumentation auch zur Dimerisation kommen – kommt es aber nicht (Chemie ist wie backen etc.).]
Löslichkeit: In Wasser nimmt die Löslichkeit mit zunehmender Anzahl der Wasserstoffatome ab, in unpolaren Lösungsmitteln zu.
- b)
Chemische Eigenschaften
Säurewirkung:
Versuch 1: Konzentrierte Essigsäure mit Magnesiumband [→ keine Reaktion]
Versuch 2: Konzentrierte Essigsäure mit Magnesiumband und Wasser → Gasentwicklung/Mg-Band löst sich auf
[Konzentrierte Säuren können – ganz allgemein – niemals Metalle angreifen; Protonen alleine können das nicht. Nur wenn Wasser dazu kommt geht's: In diesem Fall kann das Proton, welches von der Säure abgegeben wird, mit dem Wasser zu \text{H}_3\text{O}^+
H 3 O + Erklärung:
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} \text{H}_3\text{C} & - & \text{C} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array} }}_{\text{\scriptsize Protonendonator}} + \underbrace{\text{H}_2\text{O}}_{\text{\scriptsize Protonenakzeptor}} \longrightarrow \text{H}_3\text{O}^+ + \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \overline{\text{O}}| \\ {} & & & /\!/ & \\ {} \text{H}_3\text{C} & - & \text{C} & & \\ {} & & & \backslash{} & \\ {} & & & & \underline{\overline{\text{O}}}|^\ominus \end{array} }}_{\text{\scriptsize Ethanoation}}
O ¯ ∣ ∕ ∕ H 3 C − C ∖ O ¯ ¯ − H ︸ Protonendonator + H 2 O ︸ Protonenakzeptor → H 3 O + + O ¯ ∣ ∕ ∕ H 3 C − C ∖ O ¯ ¯ ∣ ⊖ ︸ Ethanoation \text{H}_3\text{O}^+ + \text{Mg} \longrightarrow \text{H}_2 + \text{Mg}^{2+} + \text{H}_2\text{O}
H 3 O + + Mg → H 2 + Mg 2 + + H 2 O \text{Mg}^{2+} + { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} \text{H}_3\text{C} & - & \text{C} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array} } \longrightarrow \underbrace{\text{Mg}\!\left({ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \overline{\text{O}}| \\ {} & & & /\!/ & \\ {} \text{H}_3\text{C} & - & \text{C} & & \\ {} & & & \backslash{} & \\ {} & & & & \underline{\overline{\text{O}}}|^\ominus \end{array} }\right)_2}_{\text{\scriptsize [Magnesiumethanoat]}}
Mg 2 + + O ¯ ∣ ∕ ∕ H 3 C − C ∖ O ¯ ¯ − H → Mg O ¯ ∣ ∕ ∕ H 3 C − C ∖ O ¯ ¯ ∣ ⊖ 2 ︸ [Magnesiumethanoat] [XXX eigentlich fehlt doch noch das \text{H}_2
H 2 [Allgemeines] Carboxylation [mesomeriestabilisiert]:
\left[{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \overline{\text{O}}| \\ {} & & & /\!/ & \\ {} \text{R} & - & \text{C} & & \\ {} & & & \backslash{} & \\ {} & & & & \underline{\overline{\text{O}}}|^\ominus \end{array} } \longleftrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & & & & \underline{\overline{\text{O}}}|^\ominus \\ {} & & & / & \\ {} \text{R} & - & \text{C} & & \\ {} & & & \backslash\!\backslash & \\ {} & & & & \underline{\text{O}}| \end{array} }\right]
O ¯ ∣ ∕ ∕ R − C ∖ O ¯ ¯ ∣ ⊖ ↔ O ¯ ¯ ∣ ⊖ ∕ R − C ∖ ∖ O ¯ ∣