0.0.0.1 ↑ Ester
Versuch: Ethanol + Essigsäure + \text{H}_2\text{SO}_4
Beobachtung: Lösungsmittelgeruch, nicht mischbar mit Wasser
Erklärung:
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & | & & | & & & & \\ {} - & \text{C} & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{H} \\ {} & | & & | & & & & \end{array} }}_{\text{\scriptsize Ethanol}} + \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & & |\overline{\text{O}} & & & & & \\ {} & & & \backslash\!\backslash & & & | & \\ {} & & & & \text{C} & - & \text{C} & - \\ {} & & & / & & & | & \\ {} \text{H} & - & \overline{\underline{\text{O}}} & & & & & \end{array} }}_{\text{\scriptsize Ethansäure}} \stackrel{\text{\scriptsize Kondensation}}{\longrightarrow} \text{H}_2\text{O} + \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & & & & & & & ^/\text{\textbf{O}}^\backslash & & & \\ {} & | & & | & & & & \vert\vert{} & & | & \\ {} - & \text{C} & - & \text{\textbf{C}} & - & \overline{\underline{\text{\textbf{O}}}} & - & \text{\textbf{C}} & - & \text{C} & - \\ {} & | & & | & & & & & & | & \end{array} }}_{\text{\scriptsize Ethylethanoat}}
[Das C-Atom mit den Verbindungen zu den zwei O-Atomen kann bei anorganischen Estern auch beispielsweise ein N sein.]
[Funktionelle Gruppe:]
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & & ^/\text{\textbf{O}}^\backslash & \\ {} & & & & & \vert\vert{} & \\ {} - & \text{\textbf{C}} & - & \overline{\underline{\text{\textbf{O}}}} & - & \text{\textbf{C}} & - \\ {} & & & & & | & \end{array} }\text{ ]Estergruppe}
Versuch: Ethylethanoat + \text{H}_2\text{O} + NaOH + Phenolphthalein
Beobachtung: Entfärbung der roten [basischen] Lösung [zum Neutralen]
Erklärung:
\begin{array}{@{}l}{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & & & & & & & ^/\text{O}^\backslash & & & \\ {} & | & & | & & & & \vert\vert{} & & | & \\ {} - & \text{C} & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{C} & - & \text{C} & - \\ {} & | & & | & & & & & & | & \end{array} } + \text{NaOH} \stackrel{\text{\scriptsize Hydrolyse}}{\longrightarrow} \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & | & & | & & & & \\ {} - & \text{C} & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{H} \\ {} & | & & | & & & & \end{array} }}_{\text{\scriptsize Ethanol}} + { \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} & & & & & \overline{\text{O}}| \\ {} & | & & & /\!/ & \\ {} - & \text{C} & - & \text{C} & & \\ {} & | & & & \backslash{} & \\ {} & & & & & \overline{\underline{\text{O}}}|^\ominus \end{array} } + \text{Na}^\oplus\end{array}
Allgemein:
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} \text{R}_1 & - & \text{C} & & & & \\ {} & & & \backslash{} & & & \\ {} & & & & \overline{\underline{\text{O}}} & - & \text{H} \end{array} }}_{\text{\scriptsize Carbonsäure}} + \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{R}_2 & - & \overline{\underline{\text{O}}} & - & \text{H} \end{array} }}_{\text{\scriptsize Alkohol}} \begin{array}{ccc}\text{\scriptsize Kondensation}\\\rightleftharpoons\\\text{\scriptsize Hydrolyse}\end{array} \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & ^/\text{O}^\backslash & & & & \\ {} & & \vert\vert{} & & & & \\ {} \text{R}_1 & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{R}_2 \end{array} }}_{\text{\scriptsize Ester}} + \underbrace{\text{H}_2\text{O}}_{\text{\scriptsize Wasser}}
[Gleichgewichtsverschiebung um gewünschte Stauffausbeite zu erhöhen]
[Siedepunkt von Ester ungefähr genauso groß wie der von Alkanalen (XXX evtl. falsch!); keine Wasserstoffbrückenbindungen, aber Polarität]
0.0.0.1.1 ↑ Verwendung
Aromastoff
Lösungsmittel
Fette und Öle (Glycerinester mit höheren Carbonsäuren)
Nitroglycerin
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} & | & & & \\ {} - & \text{C} & - & \text{O} & \text{H} \\ {} & | & & & \\ {} - & \text{C} & - & \text{O} & \text{H} \\ {} & | & & & \\ {} - & \text{C} & - & \text{O} & \text{H} \\ {} & | & & & \end{array} }}_{\text{Glycerin}} + 3\,\text{HNO}_3 \longrightarrow \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccc} {} & | & & & & \\ {} - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{NO}_2 \\ {} & | & & & & \\ {} - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{NO}_2 \\ {} & | & & & & \\ {} - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{NO}_2 \\ {} & | & & & & \end{array} }}_{\text{Nitroglycerin}} + 3\,\text{H}_2\text{O}
[Das -\overline{\underline{\text{O}}}- nennt man Etherbrücke.]
[Nitroglycerin ist in Wasser gelöst ok; es geht erst bei Erschütterungen hoch. Lagerung bei ca. -10 °C.]
Kunststoffe
n \cdot \left[\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccc} {} & & |\overline{\text{O}} & & & & & & & & \overline{\text{O}}| & & \\ {} & & & \backslash\!\backslash & & & & & & /\!/ & & & \\ {} & & & & \text{C} & - & ^/_\backslash\overline{\underline{\bigcirc}}^\backslash_/ & - & \text{C} & & & & \\ {} & & & / & & & & & & \backslash{} & & & \\ {} \text{H} & - & \underline{\text{O}}| & & & & & & & & |\underline{\text{O}} & - & \text{H} \end{array} }}_{\text{Terephtalsäure}} + { \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} \text{H} & \text{O} & - & \text{CH}_2 & - & \text{CH}_2 & - & \text{O} & \text{H} \end{array} }\right] \longrightarrow n \text{H}_2\text{O} + \left[\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccccc} {} & |\overline{\text{O}} & & & & & & & & \overline{\text{O}}| & & & & & & & \\ {} & & \backslash\!\backslash & & & & & & /\!/ & & & & & & & & \\ {} & & & \text{C} & - & ^/_\backslash\overline{\underline{\bigcirc}}^\backslash_/ & - & \text{C} & & & & & & & & & \\ {} & & / & & & & & & \backslash{} & & & & & & & & \\ {} - & \underline{\text{O}}| & & & & & & & & |\underline{\text{O}} & - & \text{CH}_2 & - & \text{CH}_2 & - & \overline{\underline{\text{O}}} & - \end{array} }}_{\text{Polyethylenterephtalat}}\right]_n
0.0.0.1.2 ↑ Estergleichgewicht
A + B \rightleftharpoons C \quad \Delta H < 0
\overrightarrow{v} = \overleftarrow{v} [v_{\text{hin}} = v_{\text{rück}} → Gleichgewicht]
Beeinflussung [der] Reaktionsgeschwindigkeit:
c
T [Temperaturerniedrigung bevorzugt exotherme Reaktion]
P [Druckerhöhung bevorzugt Reaktionsergebnis mit geringerer Teilchenzahl]
Katalysator
Beispiel:
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccc} {} & & & & & & & ^/\text{O}^\backslash & & & \\ {} & & & & & & & \vert\vert{} & & & \\ {} - & \text{C} & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{C} & - & \text{C} & - \end{array} } + \text{H}_2\text{O} \leftrightharpoons { \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} - & \text{C} & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{H} \end{array} } + \text{H}_3\text{C}{-}\text{COOH} \quad \Delta H > 0
Das Gleichgewicht kann nach dem Prinzip von Le Chatelier beeinflusst werden (Prinzip des kleinsten Zwanges).
- a)
Konzentrationsänderung [Ziel: größere Esterausbeute]
\text{H}_2\text{O}-Entzug
Erhöhung [der] Alkanol[-Konzentration]
- b)
Temperaturerniedrigung
0.0.0.1.3 ↑ Multifunktionelle Verbindungen
Versuch: Salicylsäure + Methanol
Beobachtung: Typischer Estergeruch
Erklärung:
\underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} ^/_\backslash\overline{\underline{\bigcirc}}^\backslash_/ & - & \text{C} & & & & \\ {} & \backslash{} & & \backslash{} & & & \\ {} & \text{H} & \text{O} & & \overline{\underline{\text{O}}} & - & \text{H} \end{array} }}_{\text{[2-Hydroxybenzolcarbonsäure]}} + { \setlength{\arraycolsep}{0pt} \begin{array}{ccccc} {} \text{H}_3\text{C} & - & \overline{\underline{\text{O}}} & - & \text{H} \end{array} } \longrightarrow { \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & & & & \overline{\text{O}}| & & & \\ {} & & & /\!/ & & & & \\ {} ^/_\backslash\overline{\underline{\bigcirc}}^\backslash_/ & - & \text{C} & & & & & \\ {} & \backslash{} & & \backslash{} & & & | & \\ {} & \text{H} & \text{O} & & \overline{\underline{\text{O}}} & - & \text{C} & - \\ {} & & & & & & | & \end{array} } + \text{H}_2\text{O}
Mehrfunktionelle Verbindungen besitzen mehrere verschiedene funktionelle Gruppen.
[Eigentlich kann man das "verschieden" im vorherigen Satz streichen – aber blablabla]
0.0.0.1.3.1 ↑ Biologisch bedeutsame Verbindungen
- a)
Glycerinaldehyd (2,3-Dihydroxypropanal) [immer das höchstoxidierteste C ist Nummer 1!!]
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & & \text{H} & & \text{H} & & & & \overline{\text{O}}| \\ {} & & | & & | & & & /\!/ & \\ {} \text{H} & - & \text{C} & - & \text{C} & - & \text{C} & & \\ {} & & | & & | & & & \backslash{} & \\ {} & \text{H} & \text{O} & & \text{O} & \text{H} & & & \text{H} \end{array}
Vorkommen: Als Glycerinaldehydphosphat im Zuckerstoffwechsel (Glycolyse)
- b)
Brenztraubensäure (2-Ketopropansäure)
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccc} {} & & \text{H} & & & & & & \overline{\text{O}}| & \\ {} & & | & & & & & /\!/ & & \\ {} \text{H} & - & \text{C} & - & \text{C} & - & \text{C} & & & \\ {} & & | & & \vert\vert{} & & & \backslash{} & & \\ {} & & & & _\backslash\text{O}_/ & & & & \text{O} & \text{H} \end{array}
Vorkommen: Entsteht im Körper beim Zuckerstoffwechsel
Alkoholische Gährung: → \text{C}_2\text{H}_5\text{OH} + \text{CO}_2 (anaerob)
Atmung: → \text{CO}_2 + \text{H}_2\text{O} (aerob)
Milchsäuregärung:
→ \text{C}_3\text{H}_6\text{O}_3 [→ Muskelkater ← zu wenig Sauerstoff vorhanden]
- c)
Milchsäure (2-Hydroxypropansäure)
\setlength{\arraycolsep}{0pt} \begin{array}{cccccccccc} {} & & \text{H} & & \text{H} & & & & \overline{\text{O}}| & \\ {} & & | & & | & & & /\!/ & & \\ {} \text{H} & - & \text{C} & - & \text{C} & - & \text{C} & & & \\ {} & & | & & | & & & \backslash{} & & \\ {} & & \text{H} & & \text{O} & \text{H} & & & \text{O} & \text{H} \end{array}
[Milchsäure] entsteht bei der Vergärung von Zucker durch bestimmte Bakterien.
Vorkommen: Schweiß, Blut, Muskel (Muskelkater)
Verwendung: Säuerungsmittel
- d)
Zitronensäure (3-Hydroxy-3-carboxy-1,5-dipentansäure)
\setlength{\arraycolsep}{0pt} \begin{array}{ccccccccccccccc} {} & |\overline{\text{O}} & & & & & & \text{O} & \text{H} & & & & & \overline{\text{O}}| & \\ {} & & \backslash\!\backslash & & & & & | & & & & & /\!/ & & \\ {} & & & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & - & \text{C} & & & \\ {} & & / & & & & & | & & & & & \backslash{} & & \\ {} \text{H} & \text{O} & & & & & & \text{C} & & & & & & \text{O} & \text{H} \\ {} & & & & & & /\!/ & & \backslash{} & & & & & & \\ {} & & & & & |\underline{\text{O}} & & & & \text{O} & \text{H} & & & & \end{array}
[Zitronensäure] entsteht im Körper beim aeroben Abbau von Brenztraubensäure (Zitratzyklus).
Vorkommen: Früchte, Tabak, Wein
Verwendung: Reinigungs-, Säuerungsmittel
- e)
Ascorbinsäure (Vitamin C)
Versuch: Ascorbinsäure + Fehling-Lösung
Beobachtung: Rotfärbung
Erklärung:
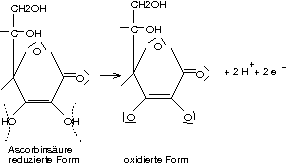
Funktionelle Gruppen: Hydroxy, Ester
Eigenschaften: Reduzierende Wirkung, Säurewirkung
Nachweise:
Fehlingprobe
Tillmans' Reagenz
\text{AscH}_2 + \text{DCPIP} \longrightarrow \text{Asc}_{\text{Ox.}} + \text{DCPIPH}_2
[Bei vielen Lebensmitteln als Antioxidans unter der Nummer E 300.]
- f)
Acetylsalicylsäure (ASS)
Darstellung:
{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccc} {} & & & & \overline{\text{O}}| & & \\ {} & & & /\!/ & & & \\ {} ^/_\backslash\overline{\underline{\bigcirc}}^\backslash_/ & - & \text{C} & & & & \\ {} & \backslash{} & & \backslash{} & & & \\ {} & \text{H} & |\underline{\text{O}} & & \overline{\underline{\text{O}}} & - & \text{H} \end{array} } + \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{ccccccccc} {} & \text{H}_3 & \text{C} & & & & \text{C} & \text{H}_3 & \\ {} & & | & & & & | & & \\ {} ^/_\backslash\text{O} & = & \text{C} & & & & \text{C} & = & \text{O}_/^\backslash \\ {} & & & \backslash{} & & / & & & \\ {} & & & & _\backslash\text{O}_/ & & & & \end{array} }}_{\text{Essigsäurehydrid}} \stackrel{\text{H}_2\text{SO}_4}{\longrightarrow} \underbrace{{ \setlength{\arraycolsep}{0pt} \begin{array}{cccccccc} {} & & & & \overline{\text{O}}| & & & \\ {} & & & /\!/ & & & & \\ {} ^/_\backslash\overline{\underline{\bigcirc}}^\backslash_/ & - & \text{C} & - & \overline{\underline{\text{O}}} & - & \text{H} & \\ {} & \backslash{} & & & & & & \\ {} & & |\underline{\text{O}} & - & \text{C} & - & \text{C} & \text{H}_3 \\ {} & & & & \vert\vert{} & & & \\ {} & & & & _\backslash\text{O}_/ & & & \end{array} }}_{\text{Acetylsalicylsäure}} + \text{H}_3\text{C}{-}\text{COOH}